
Hälsoekonomiska utvärderingar av catch-up-vaccination mot humant papillomvirus av pojkar och män och riktade insatser till specifika grupper
Sammanfattning
I detta underlag presenteras hälsoekonomiska utvärderingar av riktade insatser för catch-up-vaccination mot humant papillomvirus (HPV) till pojkar och unga män samt till män som har sex med män (MSM), i olika födelsekohorter. För båda dessa grupper samt för transpersoner och för personer som lever med hiv presenteras även en analys av budgetpåverkan för de riktade insatserna. Vi har inte gjort några kostnadseffektivitetsanalyser för transpersoner eller för personer som lever med hiv eftersom vi har bedömt att data för dessa grupper varit särskilt osäkra på grund av heterogenitet i grupperna. Sedan höstterminen 2020 erbjuds både flickor och pojkar vaccin mot HPV inom ramen för barnvaccinationsprogrammet.
Resultaten från våra analyser visar att kostnaderna för vaccination av pojkar och unga män upp till och med 26 års ålder, samt att kostnaderna för en riktad vaccinationsinsats till MSM upp till och med 26 års ålder, mot HPV är rimliga i relation till den förväntade nyttan.
De hälsoekonomiska utvärderingarna jämförde kostnader och hälsoeffekter av vaccination av pojkar och unga män uppdelat i olika födelsekohorter, respektive MSM uppdelat i olika födelsekohorter, med att inte vaccinera. Modellen som användes var en så kallad utökad SIR-modell med en tidshorisont på hundra år, som tog hänsyn till den flockimmunitet som uppstår till följd av vaccination. Kostnader som inkluderas bestod av direkta kostnader för vaccin och resursutnyttjande inom hälso- och sjukvården, samt indirekta kostnader i form av produktionsförluster vid sjukdom. Resultaten presenteras även utan medräkning av indirekta kostnader.
Resultaten från den utökade SIR-modellen visat att antalet fall av HPV-orsakad cancer som kan undvikas vid vaccination är ungefär 475–2 075 fall för catch-up-vaccination av pojkar och unga män, beroende på födelsekohort och vaccintyp, över en 100-årig tidshorisont. Motsvarande siffra för MSM är 1 140–2 580, beroende på födelsekohort och vaccintyp, under den 100-åriga tidshorisonten. Detta indikerar att catch-up-vaccination, både av pojkar och unga män och av MSM, kan ha en stor påverkan på incidensen av HPV-orsakad cancer över tid.
Resultaten från den hälsoekonomiska utvärderingen tyder på att catch-up-vaccination av samtliga födelsekohorter med både ett två-/fyrvalent vaccin och ett niovalent vaccin har en rimlig kostnad i relation till dess hälsoeffekter, baserat på Socialstyrelsens riktlinjer om att en kostnad under 500 000 kronor per kvalitetsjusterat levnadsår (QALY) kan anses vara en måttlig kostnad (1). Gruppen 17–30 år är den åldersgrupp som har den lägsta kostnaden per vunnet QALY, oavsett vaccintyp. För gruppen 17–19 år behöver priset på ett niovalent vaccin minska med strax över 10 procent för de ska ha en måttlig kostnad. Resultaten för en riktad insats till de undersökta födelsekohorterna inom MSM visar att vaccination är kostnadsbesparande och har bättre hälsoeffekter jämfört med att inte vaccinera, oavsett vaccintyp.
Känslighetsanalyser visar att resultaten från grundscenarierna i huvudsak är robusta för åldersgrupperna upp till och med 26 år. För dessa grupper finns också bra data på skyddseffekten av vaccin mot HPV-orsakad cancer. För personer 27 år och äldre är data inte lika tillförlitliga vad gäller skyddseffekt av vaccin. Vi genomförde därför analyser där vi endast undersökte kostnadseffektiviteten i grupperna 27–30 år för catch-up och gruppen 27–45 år för MSM. Resultaten från dessa analyser visade på att den stora effekten av vaccination kom från de lägre födelsekohorterna, vilket driver resultaten från de hälsoekonomiska utvärderingarna.
Kostnaden för catch-up-vaccination varierar beroende på storleken på födelsekohorten samt om ett två-/fyrvalent vaccin eller ett niovalent vaccin används, utifrån tillgängliga listpriser. Kostnaden för catch-up-vaccination varierar mellan 261 miljoner kronor för gruppen 17–19 år med ett två-/fyrvalent vaccin till 1 444 miljoner kronor för gruppen 17–30 år med ett niovalent vaccin. Kostnaden för en riktad insats för MSM varierar också mellan födelsekohort och val av vaccin. Att vaccinera MSM 17–26 år med ett två-/fyrvalent vaccin skulle kosta 57 miljoner kronor och att vaccinera MSM 17–45 år med ett niovalent vaccin skulle kosta 214 miljoner kronor. För transpersoner skulle en riktad insats innebära en kostnad om ungefär 22 miljoner kronor med ett två/fyrvalent vaccin och 36 miljoner kronor med ett niovalent vaccin. Motsvarande siffra för personer som lever med hiv skulle vara 5 miljoner kronor respektive 8 miljoner kronor.
Summary
This report presents health economic evaluations of vaccination interventions against human papillomavirus (HPV) targeting boys and young men up to the age of 30 years old and men who have sex with men (MSM) up to the age of 45 years old. As of the fall of 2020, both girls and boys are offered vaccination against HPV in the national vaccination program for children.
The health economic evaluation compared the costs and health effects of vaccination of boys and young men, divided into different age groups, as well as vaccination of MSM, divided into different age groups, to no vaccination. We used a so-called extended SIR model with a time horizon of a hundred years to investigate the effects of vaccination, including the effects of herd immunity on the non-vaccinated population. The costs consisted of both direct costs of the vaccine and resource use in health care, as well as indirect costs in the form of production losses. The results are also presented without including production losses.
The results from the health economic evaluation indicate that catch-up vaccination can be considered to have a reasonable cost in relation to its health effect, regardless of vaccine type, in all age groups. The age group of 17–30 year olds has the lowest cost per gained quality-adjusted life year (QALY). Results for the targeted interventions for MSM show that vaccination is cost saving and has better health effects than not vaccinating.
Sensitivity analyses show that the results are robust for age groups up to 26 years old, both for catch-up vaccination and for MSM. For age groups older than that, data on vaccine effectiveness is scarce. When we single out the age groups 27 years and older, both for catch-up vaccination and MSM, the cost per gained QALY increases significantly, implying that it is the younger age groups that drive the results.
Om publikationen
Den 3 augusti 2023 gav regeringen Folkhälsomyndigheten i uppdrag att utreda behov av och kostnader för att erbjuda så kallad catch-up-vaccination mot humant papillomvirus (HPV) till pojkar respektive män som inte har erbjudits vaccination genom det allmänna vaccinationsprogrammet för barn (2).
Uppdraget omfattade även att utreda behov av och kostnader för ett särskilt erbjudande om vaccination mot HPV till män som har sex med män (MSM), transpersoner och personer som lever med hiv. I uppdraget ingick även att göra hälsoekonomiska utvärderingar, vilka presenteras i denna bilaga.
Ellen Wolff, senior hälsoekonom, och Sofie Larsson, senior hälsoekonom, har varit projektledare för de hälsoekonomiska utvärderingarna. Ansvarig chef är enhetschef Lisa Brouwers på enheten för analys.
Folkhälsomyndigheten
Karin Tegmark Wisell
Generaldirektör
Förkortningar
CDC – Centers for Disease Control and Prevention (USA:s folkhälsomyndighet)
HPV – Human papillomvirus
ICER – Inkrementell kostnadseffektivitetskvot (Incremental Cost-Effectiveness Ratio), utläsas ofta som kostnad per vunnet QALY och är skillnaden i kostnad mellan två interventioner dividerade med skillnaden i hälsoeffekt.
KPP – Kostnad per patient (databas hos SKR)
Mnkr – Miljoner svenska kronor
MSM – Män som har sex med män
QALY – Kvalitetsjusterat levnadsår (Quality-Adjusted Life Year), ett mått som kombinerar två dimensioner av hälsa – livslängd och hälsorelaterad livskvalitet.
SIR-modell – En epidemiologisk modell som ofta används för att simulera infektionssjukdomar. I modellen förflyttar sig individer mellan olika hälsostadier beroende på risk för sjukdom.
SKR – Sveriges Kommuner och Regioner
Ordlista
Dominant – Resultat från en hälsoekonomisk utvärdering som innebär att den undersökta interventionen har en bättre hälsoeffekt till en lägre kostnad jämfört med jämförelsealternativet.
Flockimmunitet – När en andel av en population är immun mot en infektionssjukdom kommer den andel av population som inte är immun mot sjukdomen också ha ett visst skydd på grund av en minskad smittspridning i hela populationen.
Födelsekohort – Personer födda under samma kalenderår
Incidens – Antal nya fall av en sjukdom i en population under en specifik tidsperiod.
Prevalens – Antalet fall av en sjukdom i en population under en specifik tidsperiod.
Bakgrund
Folkhälsomyndigheten har fått i uppdrag att utreda behov och kostnader för att erbjuda vaccination mot humant papillomvirus (HPV) till de pojkar och unga män som inte erbjudits vaccination genom det allmänna vaccinationsprogrammet, samt till män som har sex med män (MSM), transpersoner och personer som lever med hiv. Inom regeringsuppdraget ingick att genomföra hälsoekonomiska analyser.
I detta underlag presenteras en hälsoekonomisk utvärdering av en riktad insats för catch-up-vaccination till pojkar och unga män samt till MSM. Folkhälsomyndigheten har tidigare utrett de hälsoekonomiska effekterna av HPV-vaccin inom det nationella allmänna vaccinationsprogrammet för barn (härefter benämnt barnvaccinationsprogrammet) och publicerat två underlag som finns tillgängliga på myndighetens webbplats (3, 4). Vid båda dessa utredningar bedömde myndigheten att vaccination av pojkar mot HPV uppfyller smittskyddslagens kriterier för att ingå i ett nationellt vaccinationsprogram, däribland att vaccination kan förväntas vara samhällsekonomiskt kostnadseffektivt.
Vaccination av flickor mot HPV infördes i barnvaccinationsprogrammet 2010 med syftet att ge skydd mot livmoderhalscancer. Sedan dess har kunskapen om HPV-orsakad cancer och dess epidemiologi utvecklats betydligt. HPV-infektioner kopplas till en rad cancerformer hos både män och kvinnor. Varje år drabbas över 800 kvinnor och över 300 män i Sverige av HPV-orsakad cancer. Bland män rör det sig främst om cancer i mun och svalg, penis och anus. Flickor födda 1999 och senare har erbjudits vaccination mot HPV inom barnvaccinationsprogrammet, därtill har flera regioner erbjudit catch-up-vaccination till andra födelsekohorter och sedan våren 2021 erbjuds alla kvinnor födda 1994–1999 gratis vaccination mot HPV inom en studie som samtliga regioner deltar i (5). Från och med höstterminen 2020 erbjuds både flickor och pojkar vaccin mot HPV inom barnvaccinationsprogrammet. Programmet omfattar pojkar födda 2009 och senare.
Syftet med nuvarande utredning är att utvärdera de hälsoekonomiska effekterna av att erbjuda HPV-vaccination till ovaccinerade pojkar och unga män och MSM i likhet med vad som tidigare erbjudits unga kvinnor inom ramen för en studie. Utvärderingen grundar sig i den modell som utvecklades för de tidigare HPV-utredningarna för pojkar (3, 4).
Metod
I detta avsnitt presenteras de hälsoekonomiska utvärderingarna av en riktad insats av vaccination mot HPV till pojkar och unga män respektive MSM. Utvärderingarna är indelade i flera subanalyser utifrån födelsekohorter.
De antaganden som gjorts och inkluderats i den hälsoekonomiska modellen bygger i huvudsak på det kunskapsunderlag som är framtaget inom ramen för regeringsuppdraget. Där publicerade data saknats och antaganden har krävts för parametervärden har vi rådfrågat svenska och nordiska experter. Vi har utfört känslighetsanalyser för att undersöka om modellens resultat är robusta, alltså om resultaten och dess slutsatser inte ändras i någon större utsträckning när vi ändrar värde på ingående parametrar i modellen.
Hälsoekonomisk modell
Modellen som använts för denna utvärdering togs fram på Folkhälsomyndigheten i samband med utredningen av HPV-vaccin till pojkar inom barnvaccinations-programmet 2017 och den uppdaterade utvärdering som presenterades 2019 (3, 4). Resultat från modellen har även publicerats i vetenskaplig publikation 2018 (6). I detta underlag har modellen anpassats efter de födelsekohorter som vi identifierat som relevanta för en riktad insats och data som utvärderingen bygger på har uppdaterats därefter. Nedan följer en kort beskrivning av modellen. För fördjupad information hänvisas till tidigare publicerade underlag av Folkhälsomyndigheten och Wolff et al (3, 4, 6).
Modellen är en utökad SIR-modell där individer kan vara mottagliga för infektion (S – susceptible), infekterade (I – infected) eller återställda från infektion eller sjukdom (R – recovered), samt tar hänsyn till andelen vaccinerade i populationen som är mottaglig för infektion. En förenklad illustration av modellen presenteras i figur 1. Individer kan flytta mellan olika hälsostadier utifrån olika övergångssannolikheter baserade på ålder och kön, enligt vad som presenteras i nästa avsnitt. I analysen följs en kohort över en livstidshorisont, men max i 100 år. Storleken på kohorten beror på vilket scenario vi utvärderar. Dessa scenarier presenteras i kommande avsnitt.
Figur 1. Förenklad illustration av SIR-modellen.
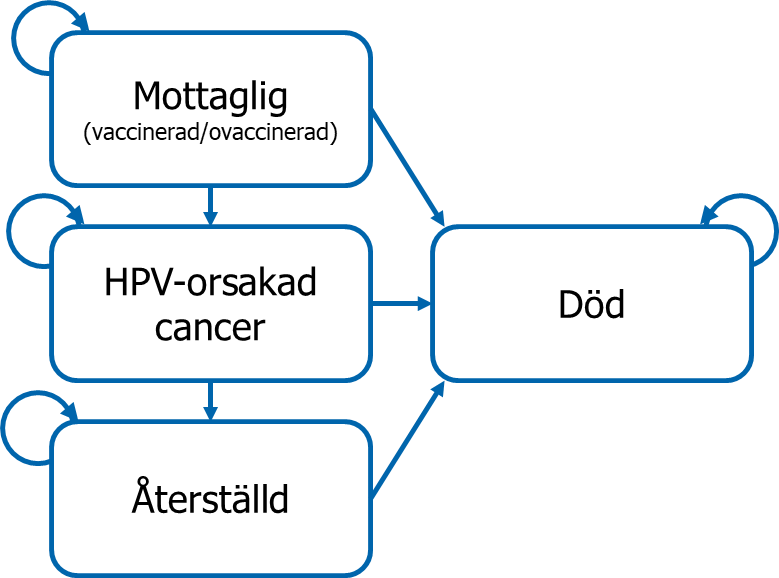
För män inkluderas tre typer av HPV-orsakad cancer:
- analcancer
- orofarynxcancer (tungbas, tonsill och övriga delar av mellansvalget)
- peniscancer
För kvinnor inkluderas 5 typer av HPV-orsakad cancer:
- analcancer
- cervixcancer (livmoderhalscancer)
- orofarynxcancer (tungbas, tonsill och övriga delar av mellansvalget)
- vaginalcancer
- vulvacancer
- De hälsoekonomiska aspekterna beräknas genom att kostnader och livskvalitetspåverkan kopplas till respektive hälsotillstånd. Både kostnader och hälsoeffekter diskonteras med tre procent årligen. Cykellängd i modellen är ett år. Modellen består av flera moduler baserat på ålder och förflyttning mellan moduler sker med en 1-årig födelsekohort per år.
Scenarier
De hälsoekonomiska utvärderingarna av catch-up vaccination av pojkar och unga män samt MSM utgår från vaccination av tidigare ovaccinerade individer.
Catch-up-vaccination
I utvärderingen har vi valt att utgå från tre kohorter som kan bli aktuella för en riktad insats baserat på ålder. Vi utgår från att en insats kan bli aktuell först 2025. I ett sådant scenario kommer alla pojkar till och med 16 år att ha erbjudits vaccination inom ramen för barnvaccinationsprogrammet (födda 2009 eller senare).
Följande födelsekohorter kan därför bli aktuella för en catch-up-insats:
- 17–19 år (födda 2006–2008)
- 17–26 år (födda 1999–2008)
- 17–30 år (födda 1995–2008)
Jämförelsen för respektive födelsekohort görs mot att ingen erbjuds vaccination.
Män som har sex med män
I utvärderingen av en riktad insats mot MSM har vi utgått från två kohorter som kan bli aktuella för vaccination givet att vaccinationsinsatsen inleds 2025:
- 17–26 år (födda 1999–2008)
- 17–45 år (födda 1980–2008)
Jämförelserna för respektive födelsekohort görs mot att ingen erbjuds vaccination.
Parametrar i modellen
Populationsstorlek
I modellen används den genomsnittliga befolkningen för åren 2018-2022 för respektive grupp vid catch-up-vaccination. Det innebär en population enligt nedan:
- 17–19: 178 845 individer
- 17–26: 625 357 individer
- 17–30: 932 537 individer
För MSM antar vi att ungefär 6 procent av individerna i åldrarna 17–26 är MSM och motsvarande siffra i gruppen 27–30 är ungefär 5 procent (7). De som är aktuella för vaccination i modellen beräknas sedan enligt antagandena i tabell 1 och tabell 2.
Vaccinationstäckning
Vaccinationstäckningen i relevanta åldrar är i dagsläget oklar eftersom få vaccinationer utanför barnvaccinationsprogrammet registreras. Vi har antagit att en viss del av männen har vaccinerat sig även utan en riktad insats. Andelen är hämtad från en publicerad studie av Amaneta et al (8) som visat att 5–30 procent av amerikanska män 13–45 år är vaccinerade utan riktad insats. I tabell 1 och tabell 2 presenteras de siffror som används i modellen. Andelen män vaccinerade utan en riktad insats används för att justera storleken på populationen som är aktuell för vaccination om en eventuell insats riktad mot pojkar och unga män eller MSM genomförs. Vaccinationstäckning med catch-up-vaccination eller en riktad insats mot MSM som anges i tabell 1 och 2 är den som används för den tidigare ovaccinerade populationen. Vi har utgått från den lägsta angivna procentsatsen per åldersgrupp från studien.
Vaccinationstäckning vid en riktad insats för pojkar och unga män eller MSM är baserat på antaganden om var och hur individer i olika åldrar nås. Vi har antagit att pojkar 17–19 år kan vaccineras genom elevhälsan och att en högre vaccinationstäckning därför är möjlig för denna grupp jämfört med äldre åldrar som i mindre utsträckning kommer i kontakt med vårdgivare som erbjuder vaccination.
| Strategi | 17–19 år | 20–26 år | 27–30 år | Referens |
|---|---|---|---|---|
| Vaccinationstäckning utan catch-up-vaccination (procent) | 15 | 10 | 5 | Antagande. Baserat på (8) |
| Vaccinationstäckning med catch-up-vaccination (procent) bland tidigare ovaccinerade | 60 | 40 | 20 | Antagande |
| Strategi | 17–26 år | 27–45 år | Referens |
|---|---|---|---|
| Vaccinationstäckning utan riktad insats (procent) | 15 (17–19 år)10 (20–26 år) | 5 | Antagande. Baserat på (8) |
| Vaccinationstäckning med riktad insats (procent) bland tidigare ovaccinerade | 60 | 40 | Antagande |
För att beräkna budgetpåverkan för transpersoner och för personer som lever med hiv har vi även gjorts antaganden om vaccinationstäckning för dessa grupper. För personer som lever med hiv har vi antagit en vaccinationstäckning om 80 procent för 17–26 åringar och 60 procent för 27–45 åringar. För transpersoner har vi antagit samma vaccinationstäckning som för MSM.
Skyddseffekt av vaccin
Skyddseffekten av HPV-vaccinen beror på sannolikheten att redan vara eller ha varit infekterad med HPV och andelen HPV-orsakad cancer som är orsakad av HPV 16 och 18 respektive HPV 16, 18, 31, 33, 45, 52 och 58 (alternativt hög-risk HPV om data för specifika HPV-typer saknas) för att spegla de olika vaccinerna samt att vaccinationseffekten för en HPV-naiv person är 90 procent (9, 10). Sannolikheten för HPV-infektion är baserat på prevalens från en studie av Bruni et al från 2023 (11) som visat att prevalensen hos män i Europa är sex procent för HPV 16 och 18, respektive elva procent för HPV 16, 18, 31, 33, 45, 52 och 58. I grundanalysen antog vi samma skyddseffekt av vaccin, beroende på vaccintyp, för samtliga födelsekohorter som är aktuella för catch-up vaccination. Detta antagande varierades i en känslighetsanalys, eftersom det är troligt att skyddseffekten är lägre bland de som är 27 år och äldre eftersom den gruppen har varit exponerade för infektion i större utsträckning.
För MSM har prevalens hämtats från en studie av Wei et al från 2021 (12). Baserat på ålder har vi beräknat sannolikhet för HPV-infektion till cirka elva procent respektive 37 procent för HPV 16 och 18 respektive HPV 16, 18, 31, 33, 45, 52 och 58 för MSM 17–26 år och 14 procent respektive 41 procent för MSM 27–45 år (12). Eftersom det är troligt att skyddseffekten av vaccin är lägre i gruppen MSM som är 27 år och äldre, genomförde vi en känslighetsanalys där vi minskade skyddseffekten av vaccin för dessa åldrar.
I tabell 3 presenteras andel HPV-orsakad cancer per cancertyp.
| Cancer | HPV 16/18 (procent) | HPV 31/33/45/52/58 (procent) | Referens |
|---|---|---|---|
| Anal | 91 | 5 | (13) |
| Orofarynx | 87 | 7 | (14) |
| Penis | 76 | 7 | (15) |
Incidens av HPV-orsakad cancer
Catch-up-vaccination
För att beräkna risken för HPV-orsakad cancer har vi utgått från rapporterad incidens av respektive cancertyp oavsett tumörtyp i Socialstyrelsens cancerregister 2018–2022 (16). Därefter har vi använt publicerad data för hur stor andel som är orsakad av HPV (alla typer), se tabell 4. I tabell 5 och tabell 6 presenteras den uträknade incidensen av HPV-orsakad cancer per cancertyp.
| Cancer | Andel av alla cancerfall som är HPV-orsakade (alla HPV-typer) (procent) | Referens |
|---|---|---|
| Cervix | 93,4 | (13) |
| Vagina | 65,8 | (13) |
| Vulva | 17,6 | (13) |
| Anal | 84,2 | (13) |
| Orofarynx | 74,0 | (14) |
| Penis | 50,0 | (17) |
| Åldersgrupp | Analcancer | Orofarynxcancer | Peniscancer |
|---|---|---|---|
| 17–19 år | 0,0 | 0,0 | 0,0 |
| 20–26 år | 0,0 | 0,0 | 0,0 |
| 27–30 år | 0,0 | 0,0 | 0,1 |
| 31–39 år | 0,2 | 0,1 | 0,2 |
| 40–49 år | 0,5 | 1,8 | 0,4 |
| 50–59 år | 1,3 | 9,4 | 1,1 |
| 60–69 år | 2,5 | 17,0 | 2,7 |
| 70–84 år | 3,9 | 12,3 | 5,2 |
| 85+ år | 2,8 | 5,9 | 9,2 |
| Åldersgrupp | Cervixcancer | Vaginalcancer | Vulvacancer | Analcancer | Orofarynxcancer |
|---|---|---|---|---|---|
| 17–19 år | 0,1 | 0,0 | 0,0 | 0,0 | 0,0 |
| 20–26 år | 1,9 | 0,0 | 0,0 | 0,0 | 0,0 |
| 27–30 år | 8,8 | 0,1 | 0,0 | 0,0 | 0,0 |
| 31–39 år | 18,6 | 0,0 | 0,0 | 0,3 | 0,1 |
| 40–49 år | 16,3 | 0,2 | 0,1 | 1,1 | 1,1 |
| 50–59 år | 12,7 | 0,3 | 0,4 | 4,0 | 3,6 |
| 60–69 år | 11,7 | 0,5 | 1,1 | 7,3 | 5,9 |
| 70–84 år | 13,6 | 1,5 | 2,0 | 8,3 | 4,2 |
| 85+ år | 11,4 | 2,3 | 3,2 | 5,9 | 1,4 |
Män som har sex med män
För att ta hänsyn till en ökad incidens av HPV-orsakad cancer hos MSM har vi justerat incidensdata från Cancerregistret, som vi använt för utvärderingen av catch-up-vaccination, utifrån publicerade studier. Andelen cancerfall som är HPV-orsakade följer samma antagande som gjorts för catch-up-vaccination, se tabell 4.
Enligt amerikanska data och CDC har homosexuella, bisexuella och andra män som har sex med män ungefär en 17 gånger högre risk att få analcancer än heterosexuella män (18, 19). Vi har utgått från den relativa skillnaden av analcancer incidens hos män som har sex med kvinnor och MSM i en amerikansk studie (18) för att räkna fram en multiplikationsfaktor som vi sedan har använt för att räkna upp incidensen i MSM-populationen. Enligt detta sätt att räkna är incidensen cirka 14 gånger högre för MSM jämfört med män som har sex med kvinnor beroende på åldersgrupp. Vi har inte kunnat identifiera studier som analyserar incidens av penis- eller orofarynxcancer utifrån motsvarande grupper och har därför valt att applicera samma multiplikationsfaktor för alla cancertyper i grundanalysen. Vi har dock varierat detta antagande i känslighetsanalyser där vi har använt en lägre multiplikationsfaktor för penis- och orofarynxcancer (20).
I tabell 7 presenteras incidens för MSM i olika födelsekohorter.
| Födelsekohorter | Analcancer | Orofarynxcancer | Penis |
|---|---|---|---|
| 17–19 år | 0,0 | 0,0 | 0,0 |
| 20–26 år | 0,0 | 0,0 | 0,0 |
| 27–45 år | 0,1 | 0,3 | 0,2 |
| 46–49 år | 0,8 | 2,6 | 0,5 |
| 50–59 år | 1,3 | 9,4 | 1,1 |
| 60–69 år | 2,5 | 17,0 | 2,7 |
| 70–84 år | 3,9 | 12,3 | 5,2 |
| 85+ år | 2,8 | 5,9 | 9,2 |
Svårighetsgrad
För att ta hänsyn till att cancer upptäcks i olika stadium av sjukdomen har vi delat in cancertyperna i två eller tre grupper för svårighetsgrad (A, B, C), där A betecknar de lindrigaste stadierna av sjukdomen, B ett något allvarligare stadium och C betecknar de allvarligaste stadierna av sjukdomen. I tabell 8 anges hur respektive cancertyp har fördelats i modellen och i tabell 9 och tabell 10 presenteras hur fallen av cancer fördelar sig över de tre svårighetsgraderna beroende på ålder vid diagnos. Fördelningen av svårighetsgrad är den samma som användes i de tidigare HPV-utredningarna för pojkar (3, 4).
| Svårighetsgrad | A | B | C | Referens |
|---|---|---|---|---|
| Cervix (a) | I | II | III+IV | Expertutlåtande |
| Vagina (a) | I | II | III+IV | Expertutlåtande |
| Vulva (a) | I | II | III+IV | Expertutlåtande |
| Anal | - | T1–T2 (<4 cm) n+m0 (b)> | T2 (>4 cm) T4N0/N+M0 (b) | Expertutlåtande |
| Orofarynx | - | I+II | III+IV | Expertutlåtande |
| Penis | Icke-invasiv, utan metastaser i lymfkörtel | Invasiv, utan metastaser i lymfkörtel | Invasiv, med metastaser i lymfkörtel | Expertutlåtande |
(a) Baserat på FIGO-stadium. (b) Baserat på TNM-stadium
| Cancertyp | A | B | C | Referens |
|---|---|---|---|---|
| Cervix | 0,81 | 0,08 | 0,11 | (21) |
| Vagina | 0,29 | 0,21 | 0,50 | (21) |
| Vulva | 0,66 | 0,03 | 0,31 | (21) |
| Anal | - | 0,25 | 0,75 | Expertutlåtande, se (3) |
| Orofarynx, kvinnorOrofarynx, män | -- | 0,10,13 | 0,90,87 | (3)(3) |
| Penis | 0,54 | 0,32 | 0,14 | (3) |
| Cancertyp | A | B | C | Referens |
|---|---|---|---|---|
| Cervix | 0,42 | 0,25 | 0,33 | (21) |
| Vagina | 0,23 | 0,29 | 0,49 | (21) |
| Vulva | 0,60 | 0,06 | 0,33 | (21) |
| Anal | - | 0,25 | 0,75 | Expertutlåtande, se (3) |
| Orofarynx, kvinnorOrofarynx, män | -- | 0,130,13 | 0,870,87 | (3)(3) |
| Penis | 0,32 | 0,53 | 0,15 | (3) |
Fördelningen över svårighetsgrad påverkar sannolikhet för överlevnad samt beräkningar av kostnader för vård, produktionsförluster och påverkan på livskvaliteten.
Överlevnad
I tabell 11 och tabell 12 presenteras data för uppskattad femårsöverlevnad per cancertyp och svårighetsgrad, för två åldersgrupper (under respektive över 50 års ålder). För cervixcancer, vaginalcancer och vulvacancer har vi utgått från data över observerad dödlighet 2018–2022 från Kvalitetsregister för gynekologisk cancer (21). För övriga cancertyper har vi utgått från de antagandena som gjordes i de tidigare HPV-utredningarna för pojkar eftersom vi inte kunnat identifiera andra data (3, 4).
| Cancertyp | A | B | C | Referens |
|---|---|---|---|---|
| Cervix | 0,97 | 0,83 | 0,63 | (21) |
| Vagina | 0,64 | 0,64 | 0,64 | (21) |
| Vulva | 0,84 | 0,71 | 0,54 | (21) |
| Anal | - | 0,75 | 0,6 | Expertutlåtande, se (3) |
| Orofarynx | - | 0,88 | 0,66 | Expertutlåtande, se (3) |
| Penis | 0,98 | 0,94 | 0,46 | (3) |
| Cancertyp | A | B | C | Referens |
|---|---|---|---|---|
| Cervix | 0,89 | 0,67 | 0,27 | (21) |
| Vagina | 0,33 | 0,33 | 0,33 | (21) |
| Vulva | 0,32 | 0,32 | 0,32 | (21) |
| Anal | - | 0,75 | 0,6 | Expertutlåtande, se (3) |
| Orofarynx | - | 0,86 | 0,68 | Expertutlåtande, se (3) |
| Penis | 0,99 | 0,81 | 0,46 | (3) |
På grund av få fall av cancer i vagina och vulva har vi använt data enbart för åldersgrupp eftersom en uppdelning per svårighetsgrad inte varit möjlig.
Flockimmunitet
I grundscenariot tar vi hänsyn till flockimmunitet, det vill säga att catch-up-vaccination av pojkar och unga män även kan ha positiva effekter för den andel kvinnor som är ovaccinerade, samt att vaccination av MSM kan ha positiva effekter för ovaccinerade MSM, genom att minska risken för att insjukna i HPV-orsakad cancer. I en känslighetsanalys tar vi bort effekten av flockimmunitet och tar då endast hänsyn till de direkta effekterna för de som vaccineras.
Vi har utgått från samma modell för flockimmunitet som i de tidigare HPV-utredningarna för pojkar (3, 4). Metoden, som är baserad på Chesson et al (22), tar hänsyn till prevalens av HPV i populationen, vaccineffekt, vaccintäckning samt sexuellt beteende.
Resursutnyttjande
Kostnad för vaccination
Det finns i dagsläget tre vaccin mot HPV som är godkända i Sverige. Ett tvåvalent vaccin som skyddar mot HPV-typerna 16 och 18, ett fyrvalent som utöver 16 och 18 även skyddar mot HPV 6 och 11, och ett niovalent som skyddar mot samma HPV-typer som det fyrvalenta samt mot HPV 31, 33, 45, 52 och 58. Alla tre vaccin ges i tre doser i modellen, i enlighet vaccinernas aktuella produktresumé. När denna rapport skrivs är endast det niovalenta vaccinet tillgängligt i Sverige.
Priserna för vaccinerna är osäkra eftersom två av vaccinen inte tillhandahålls i nuläget och det tredje vaccinet har upphandlats med sekretessbelagt pris. I tabell 13 presenteras de priser som används i grundscenarierna. Dessa är antingen baserade på nuvarande eller tidigare listpris från de tidigare HPV-utredningarna för pojkar när de fanns tillgängliga. Eftersom vaccinpriserna är osäkra har vi gjort en känslighetsanalys där vi ser hur en eventuell rabatt på vaccinen skulle påverka resultatet från grundscenarierna.
Utöver kostnaden för vaccin tillkommer även en kostnad för administration av vaccinet. Vi har antagit att pojkar 17-19 år i huvudsak kommer kunna vaccinera sig genom elevhälsan, medan unga män från 20 år kommer vaccinera sig på vårdcentral, ungdomsmottagning eller genom studenthälsan. Kostnaden för administration av vaccin baseras på löner inklusive sociala avgifter för en sjuksköterska (skolsköterska eller distriktssköterska) (23, 24), samt att varje besök tar 15 minuter. Utöver detta har vi även inkluderat en kostnad för att läkare ska ordinera vaccination (23, 24). Vi antar att en läkare lägger 5 minuter per individ som vaccineras. I tabell 13 presenteras kostnadern a för administration av vaccin.
| Resursutnyttjande vid vaccination | Pris per dos eller tillfälle | Referens |
|---|---|---|
| Tvåvalent/fyrvalent vaccin | 852 kr (a) | (3, 4) |
| Niovalent vaccin | 1 499 kr (b) | (25) |
| Administrationskostnad, sjuksköterskebesök | 83 kr | (23, 24) |
| Administrationskostnad, läkarordination | 56 kr | (23, 24) |
(a) Baserat på listpris för fyrvalent vaccin som användes i de tidigare HPV-utredningarna för pojkar, (b) Listpris
Kostnad för vård
Vårdkostnader har skattats för samtliga hälsotillstånd relaterade till cancer. Mängden vård som används i modellen är samma som i de tidigare HPV-utredningarna för pojkar (3, 4). Kostnaderna är uppdaterade till en snittkostnad per vårdtillfälle under 2020–2022 för respektive diagnoskod baserat på data från SKR:s databas Kostnad per patient (KPP) (26). Vidare har vi antagit att kostnader uppstår under en femårsperiod, beroende på skattat resursutnyttjande. Kostnader för slutenvård, öppenvård, röntgen och cytostatika har inkluderats (27-30). I tabell 14 presenteras den totala kostnaden per cancertyp och svårighetsgrad över fem år. Samtliga kostnader disko nteras med tre procent årligen.
| Cancertyp | A | B | C |
|---|---|---|---|
| Cervix | 244 700 | 266 200 | 682 800 |
| Vagina | 119 600 | 154 900 | 154 900 |
| Vulva | 130 500 | 173 100 | 173 100 |
| Anal | - | 251 700 | 369 200 |
| Orofarynx | - | 256 200 | 317 700 |
| Penis | 153 000 | 153 000 | 185 400 |
Produktionsförluster
Kostnaden för produktionsbortfall baseras på statistik från Försäkringskassan (31). Försäkringskassan har tagit fram genomsnittligt antal nettodagar med sjukpenning per diagnos 2018–2022. Data är fördelat över kvartiler. I likhet med de tidigare HPV-utredningarna för pojkar har vi antagit att första kvartilen motsvarar personer med sjukdomssvårighet A, median motsvarar personer med sjukdomssvårighet B och den fjärde kvartilen motsvarar personer med sjukdomssvårighet C. Utifrån antalet dagar har vi skattat kostnaden för produktionsbortfall genom att multiplicera med genomsnittslön (inklusive sociala avgifter) i Sverige år 2022 (23, 32). I tabell 15 presenteras de totala kostnaderna per cancertyp och svårighetsgrad. Samtliga kostnader diskonteras med tre procent årligen.
| Cancertyp | A | B | C |
|---|---|---|---|
| Cervix | 38 000 | 124 000 | 301 000 |
| Vagina | 81 900 | 225 700 | 297 200 |
| Vulva | 49 200 | 143 900 | 409 900 |
| Anal | - | 261 300 | 434 100 |
| Orofarynx | - | 268 500 | 439 200 |
| Penis | 31 400 | 128 200 | 312 500 |
Livskvalitet
Tabell 16 visar de QALY-vikter som används i modellen för respektive cancertyp och svårighetsgrad. Eftersom de modellerade kohorterna speglar en allmän befolkning har vi antagit att personer i hälsostadierna mottaglig och återställd har full hälsa, motsvarande en QALY på 1. Detta har varierats i en känslighetsanalys där QALY-vikten istället har satts till 0,9 för hälsostadierna mottaglig och återställd. Samma vikter för livskvalitet har använts i de tidigare HPV-utredningarna för pojkar (3, 4). QALY-vikten appliceras under en cykel i modellen (ett år) och livskvaliteten diskonteras med 3 procent årligen.
| Cancertyp | A | B | C | Referens |
|---|---|---|---|---|
| Cervix | 0,76 | 0,67 | 0,48 | (33) |
| Vagina | 0,64 | 0,59 | 0,54 | (34) |
| Vulva | 0,7 | 0,65 | 0,6 | (34) |
| Anal | - | 0,57 | 0,52 | (34) |
| Orofarynx | - | 0,58 | 0,53 | (34) |
| Penis | 0,84 | 0,79 | 0,74 | (34) |
Resultat
Epidemiologiska resultat
I tabell 17, tabell 18 och tabell 19 presenteras antalet ackumulerade fall av HPV relaterad cancer bland män och kvinnor, med och utan vaccination med ett två-/fyrvalent respektive ett niovalent vaccin under en 100-årig tidshorisont, vid vaccination av olika födelsekohorter av pojkar och unga män. Tabell 20 och tabell 21 presenterar antalet ackumulerade fall av HPV relaterad cancer bland MSM, med och utan vaccination med ett två-/fyrvalent respektive ett niovalent vaccin under en 100-årig tidshorisont, vid vaccination av olika födelsekohorter av MSM. Det är alltså antalet fall per år summerat över 100 år som presenteras. Eftersom modellen simulerar antalet fall av HPV-orsakad cancer med och utan vaccination för olika födelsekohorter över tid varierar antalet fall per år beroende på var vi befinner oss i modellen. Det går därför inte att tolka antalet ackumulerade antalet fall under den 100-åriga tidshorisonten som att det, delat med 100, är det genomsnittliga antalet fall per år i ett steady-state.
Resultaten i tabell 17 visar att vid catch-up-vaccination av män 17–19 år skulle 476 cancerfall bland både män och kvinnor förebyggas vid vaccination med ett två-/fyrvalent vaccin under en period på 100 år och 513 fall med ett niovalent vaccin. Motsvarande siffror för gruppen 17–26 år är 1 341 respektive 1 446 (tabell 18) och i gruppen 17–30 år 1 927 respektive 2 076 (tabell 19). Resultaten i Tabell 20 visar att vid vaccination av MSM i gruppen 17–26 år skulle 1 139 cancerfall bland män förebyggas vid vaccination med ett två-/fyrvalent vaccin under en period på 100 år och 1 210 fall med ett niovalent vaccin (tabell 20). Motsvarande siffra för gruppen MSM 17–45 år är 2 429 respektive 2 581 (tabell 21).
| Cancertyp | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin |
|---|---|---|---|
| Cervix (a) | 150 | 105 | 102 |
| Vagina (a) | 6 | 5 | 4 |
| Vulva (a) | 9 | 7 | 6 |
| Anal (a), (b) | 175 | 101 | 97 |
| Orofarynx (a), (b) | 653 | 369 | 346 |
| Penis | 178 | 110 | 104 |
| Totalt | 1 172 | 696 | 659 |
(a) Gruppen består av kvinnor i samma åldrar som männen som inkluderas i catch-up-vaccination, (b) Inkluderar både män och kvinnor
| Cancertyp | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin |
|---|---|---|---|
| Cervix (a) | 517 | 381 | 371 |
| Vagina (a) | 22 | 17 | 16 |
| Vulva (a) | 32 | 24 | 23 |
| Anal (a), (b) | 626 | 419 | 407 |
| Orofarynx (a), (b) | 2 366 | 1 570 | 1 506 |
| Penis | 647 | 460 | 444 |
| Totalt | 4 212 | 2 871 | 2 766 |
(a) Gruppen består av kvinnor i samma åldrar som männen som inkluderas i catch-up-vaccination, (b) Inkluderar både män och kvinnor
| Cancertyp | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin |
|---|---|---|---|
| Cervix (a) | 1 344 | 1 043 | 1 021 |
| Vagina (a) | 57 | 44 | 43 |
| Vulva (a) | 82 | 64 | 63 |
| Anal (a), (b) | 1 105 | 803 | 785 |
| Orofarynx (a), (b) | 3 697 | 2 641 | 2 556 |
| Penis | 986 | 748 | 726 |
| Totalt | 7 270 | 5 344 | 5 194 |
(a) Gruppen består av kvinnor i samma åldrar som männen som inkluderas i catch-up-vaccination, (b) Inkluderar både män och kvinnor
| Cancertyp | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin |
|---|---|---|---|
| Anal | 391 | 219 | 212 |
| Orofarynx | 1 870 | 1 094 | 1 043 |
| Penis | 531 | 340 | 326 |
| Totalt | 2 792 | 1 653 | 1 582 |
| Cancertyp | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin |
|---|---|---|---|
| Anal | 1 234 | 844 | 828 |
| Orofarynx | 5 661 | 4 048 | 3 942 |
| Penis | 1 638 | 1 212 | 1 182 |
| Totalt | 8 533 | 6 104 | 5 952 |
Kostnadseffektivitetsanalyser
Catch-up-vaccination
I tabell 22, tabell 23 och tabell 24 presenteras resultaten från de hälsoekonomiska utvärderingarna av catch-up vaccination av tre födelsekohorter; 17–19 år (födda 2006–2008), 17–26 år (födda 1999–2008) och 17–30 år (födda 1995–2008) var för sig. Resultaten presenteras som kostnaden per vunnet QALY (ICER).
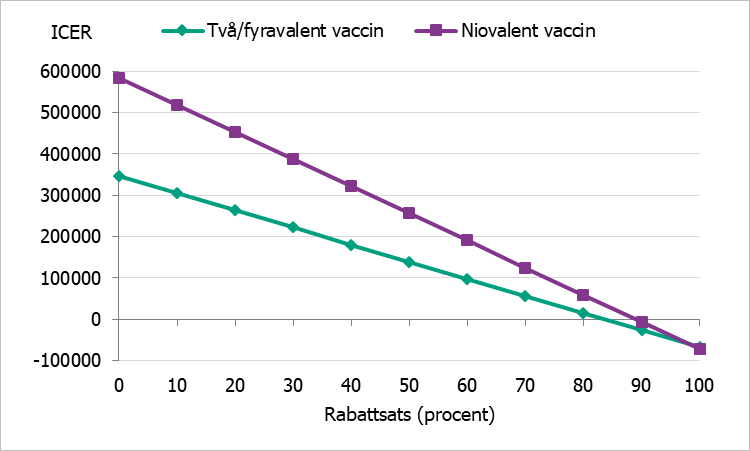
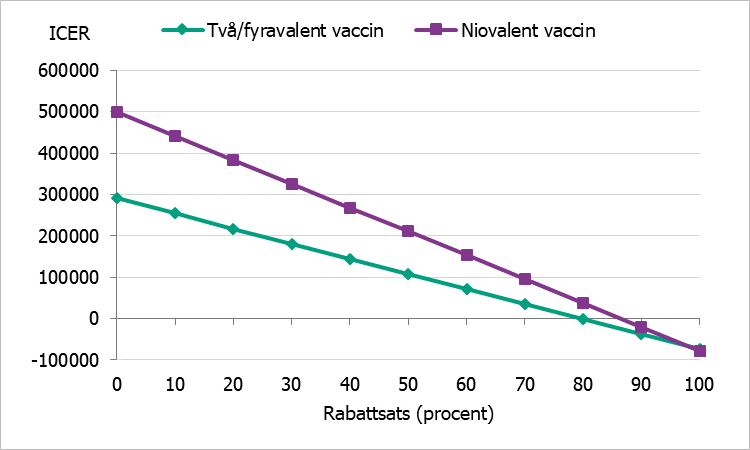
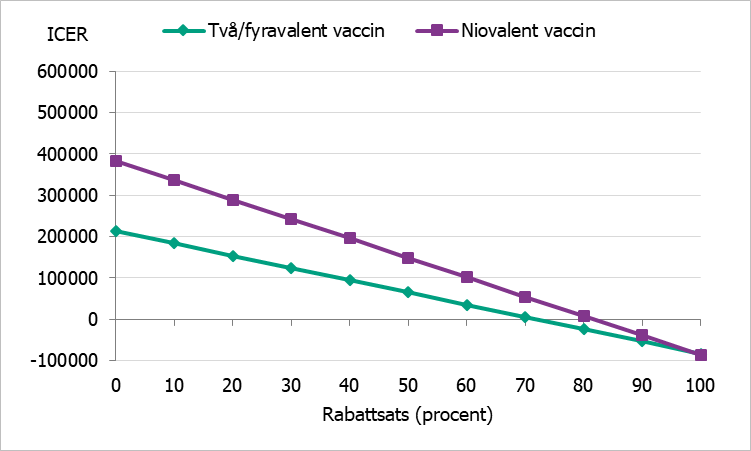
Grundscenariot har ett samhällsperspektiv och löper över en hundraårig tidshorisont. Resultaten visar att catch-up-vaccination innebär både en ökad kostnad och ökad livskvalitet i samtliga scenarier. Analyserna har gjorts för både två-/fyrvalent och niovalent vaccin jämfört med ingen vaccination. Resultatet visar att kostnaden per vunnet QALY (ICER) är ungefär 346 500 kronor, 290 500 kronor och 213 400 kronor för respektive ålderskohort vid ett två-/fyrvalent vaccin och 583 600 kronor, 499 100 kronor och 382 800 kronor för respektive födelsekohort vid ett niovalent vaccin.
| Kostnadspost | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin | Differens två-/fyrvalent vaccin mot ingen vaccination | Differens niovalent vaccin mot ingen vaccination |
|---|---|---|---|---|---|
| Vaccinationskostnad (kronor) | - | 260 986 000 | 424 372 000 | 260 986 000 | 424 372 000 |
| Hälso- och sjukvårdskostnader (kronor) | 91 399 000 | 54 805 000 | 51 993 000 | -36 594 000 | -39 406 000 |
| Produktionsbortfall (kronor) | 69 956 000 | 40 488 000 | 38 199 000 | -29 468 000 | -31 757 000 |
| Totala kostnader (kronor) | 161 356 000 | 356 279 000 | 514 564 000 | 194 923 000 | 353 208 000 |
| QALY | 4 875 660 | 4 876 220 | 4 876 260 | 560 | 600 |
| ICER (kronor) | 346 500 | 583 600 |
| Kostnadspost | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin | Differens två-/fyrvalent vaccin mot ingen vaccination | Differens niovalent vaccin mot ingen vaccination |
|---|---|---|---|---|---|
| Vaccinationskostnad (kronor) | - | 720 930 000 | 1 172 258 000 | 720 930 000 | 1 172 258 000 |
| Hälso- och sjukvårdskostnader (kronor) | 364 529 000 | 249 288 000 | 240 438 000 | -115 241 000 | -124 091 000 |
| Produktionsbortfall (kronor) | 281 151 000 | 187 969 000 | 180 733 000 | -93 182 000 | -100 418 000 |
| Totala kostnader (kronor) | 645 680 000 | 1 158 187 000 | 1 593 429 000 | 512 507 000 | 947 749 000 |
| QALY | 17 292 190 | 17 293 950 | 17 294 080 | 1 760 | 1 890 |
| ICER (kronor) | 290 500 | 499 100 |
| Kostnadspost | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin | Differens två-/fyrvalent vaccin mot ingen vaccination | Differens niovalent vaccin mot ingen vaccination |
|---|---|---|---|---|---|
| Vaccinationskostnad (kronor) | - | 887 930 000 | 1 443 806 000 | 887 930 000 | 1 443 806 000 |
| Hälso- och sjukvårdskostnader (kronor) | 706 712 000 | 526 178 000 | 512 382 000 | -180 534 000 | -194 330 000 |
| Produktionsbortfall (kronor) | 501 765 000 | 365 488 000 | 354 942 000 | -136 277 000 | -146 823 000 |
| Totala kostnader (kronor) | 1 208 478 000 | 1 779 596 000 | 2 311 129 000 | 571 118 000 | 1 102 651 000 |
| QALY | 27 807 690 | 27 810 370 | 27 810 570 | 2 680 | 2 880 |
| ICER (kronor) | 213 400 | 382 800 |
Män som har sex med män
I tabell 25 och tabell 26 presenteras resultaten från de hälsoekonomiska utvärderingarna av en riktad vaccinationsinsats mot MSM av två födelsekohorter; 17–26 år (födda 1999–2008), och 17–45 år (födda 1980–2008) var för sig. Resultaten presenteras som kostnaden per vunnet QALY (ICER).
Grundscenariot har ett samhällsperspektiv och löper över en hundraårig tidshorisont. Enligt utvärderingen innebär en riktad insats till MSM en minskad kostnad oavsett ålderskohort och vaccintyp, främst beroende på minskade behandlingskostnader och produktionsförluster. Vaccination leder också till bättre livskvalitet än ingen vaccination, på grund av minskad sjukdomsbörda. Detta innebär att ett införande av vaccination av MSM är en dominant strategi, det vill säga har en bättre effekt till en lägre kostnad.
| Kostnadspost | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin | Differens två-/fyrvalent vaccin mot ingen vaccination | Differens niovalent vaccin mot ingen vaccination |
|---|---|---|---|---|---|
| Vaccinationskostnad (kronor) | - | 57 339 000 | 93 236 000 | 57 339 000 | 93 236 000 |
| Hälso- och sjukvårdskostnader (kronor) | 220 199 000 | 127 831 000 | 122 525 000 | -92 368 000 | -97 674 000 |
| Produktionsbortfall (kronor) | 200 946 000 | 115 512 000 | 110 741 000 | -85 434 000 | -90 205 000 |
| Totala kostnader (kronor) | 421 146 000 | 300 683 000 | 326 503 000 | -120 463 000 | -94 643 000 |
| QALY | 931 170 | 932 660 | 932 740 | 1 490 | 1 570 |
| ICER (kronor) | Dominant | Dominant |
| Kostnadspost | Ingen vaccination | Två-/fyrvalent vaccin | Niovalent vaccin | Differens två-/fyrvalent vaccin mot ingen vaccination | Differens niovalent vaccin mot ingen vaccination |
|---|---|---|---|---|---|
| Vaccinationskostnad (kronor) | - | 131 774 000 | 214 268 000 | 131 774 000 | 214 268 000 |
| Hälso- och sjukvårdskostnader (kronor) | 838 470 000 | 625 054 000 | 612 792 000 | -213 416 000 | -225 678 000 |
| Produktionsbortfall (kronor) | 720 239 000 | 539 176 000 | 529 206 000 | -181 063 000 | -191 033 000 |
| Totala kostnader (kronor) | 1 558 710 000 | 1 296 004 000 | 1 356 267 000 | -262 706 000 | -202 443 000 |
| QALY | 2 609 460 | 2 612 810 | 2 612 990 | 3 350 | 3 530 |
| ICER (kronor) | Dominant | Dominant |
Känslighetsanalyser
Catch-up-vaccination
För att ta hänsyn till de eventuella rabatter som förhandlas fram mellan regionerna och vaccintillverkare, så kallade upphandlade priser, har vi gjort en känslighetsanalys där vaccinprisets påverkan på kostnaden per vunnet QALY (ICER) analyseras givet övriga antaganden i grundscenarierna. Resultatet presenteras i figur 2, figur 3 och figur 4.
Figur 2. ICER vid olika rabattsats på vaccin, gruppen 17–19 år.
Figur 3 ICER vid olika rabattsats på vaccin, gruppen 17–26 år.
Figur 4 ICER vid olika rabattsats på vaccin, gruppen 17–30 år.
För att undersöka hur robusta resultaten från grundscenarierna är, har vi utfört ett antal känslighetsanalyser på osäkra parametrar. Tabell 27, tabell 28 och tabell 29 nedan redovisar resultatet från dessa känslighetsanalyser, där enbart nämnda parametrar ändras medan övriga parametrar gäller givet antagandena i grundscenarierna.
Följande känslighetsanalyser har gjorts:
- Hälso- och sjukvårdsperspektiv istället för samhällsperspektiv: kostnader för produktionsbortfall exkluderas ur analysen.
- Utan flockimmunitet: positiva effekter på ovaccinerade kvinnor exkluderas
- QALY-vikt i hälsostadierna mottaglig och återhämtad: 0,9
- Ändrad diskonteringsränta:
- Kostnader och effekter diskonteras inte
- Hälsoeffekter diskonteras med 1,5 procent
- Vaccinationstäckning justeras: vaccinationstäckningen ökas respektive minskas med 10 procentenhet i respektive födelsekohort vid catch-up-vaccination.
- Skyddseffekt av vaccin justeras: Skyddseffekten av vaccin justeras till 10 procent för alla individer i åldrarna 27–30 och alla cancertyper baserat på vaccineffekt för individer med okänd status vad gäller HPV-infektion.
| Känslighetsanalys | ICER Två /fyrvalent vaccin (kronor) | ICER Niovalent vaccin (kronor) |
|---|---|---|
| Hälso- och sjukvårdsperspektiv | 399 000 | 636 000 |
| Utan flockimmunitet | 550 500 | 893 000 |
| QALY-vikt i hälsostadierna mottaglig/återhämtad: 0,9 | 381 400 | 642 000 |
| Diskonteringsränta0 procent för både kostnader och hälsoeffekter3 procent för kostnader, 1,5 procent för hälsoeffekter | 19 800178 000 | 76 700299 700 |
| Vaccinationstäckning– 10 procentenheter+ 10 procentenheter | 419 700291 000 | 693 200498 600 |
| Känslighetsanalys | ICER Två-/fyrvalent vaccin (kronor) | ICER Niovalent vaccin (kronor) |
|---|---|---|
| Hälso- och sjukvårdsperspektiv | 343 300 | 552 000 |
| Utan flockimmunitet | 457 600 | 752 900 |
| QALY-vikt i hälsostadierna mottaglig/återhämtad: 0,9 | 319 200 | 548 500 |
| Diskonteringsränta0 procent för både kostnader och hälsoeffekter3 procent för kostnader, 1,5 procent för hälsoeffekter | 16 900157 700 | 73 000270 900 |
| Vaccinationstäckning– 10 procentenheter+ 10 procentenheter | 346 500229 100 | 583 600406 700 |
| Känslighetsanalys | ICER Två-/fyrvalent vaccin (kronor) | ICER Niovalent vaccin (kronor) |
|---|---|---|
| Hälso- och sjukvårdsperspektiv | 264 300 | 433 800 |
| Utan flockimmunitet | 406 100 | 676 000 |
| QALY-vikt i hälsostadierna mottaglig/återhämtad: 0,9 | 231 700 | 415 600 |
| Diskonteringsränta0 procent för både kostnader och hälsoeffekter3 procent för kostnader, 1,5 procent för hälsoeffekter | 6 800125 400 | 59 200224 900 |
| Vaccinationstäckning– 10 procentenheter+ 10 procentenheter | 290 400160 600 | 499 100303 200 |
| Skyddseffekt av vaccin i gruppen 27–30 år | 250 300 | 440 000 |
Resultaten från känslighetsanalyserna tyder på att rapportens resultat och slutsats kan anses vara robusta, eftersom kostnaderna fortsätter vara rimliga i relation till dess hälsoeffekter även vid justeringar av de flesta parametervärden. När effekten av flockimmunitet bortsågs från ökade dock kostnaderna per vunnet QALY för vaccination med ett niovalent vaccin till nivåer som inte anses vara måttliga enligt Socialstyrelsens riktlinjer (1).
Eftersom data är osäkra för skyddseffekt av vaccination för gruppen 27 år och äldre genomförde vi även en känslighetsanalys där vi separat undersökte kostnaden per vunnet QALY i den åldersgruppen. Kostnaden per vunnet QALY varierade då mellan ungefär 3 miljoner och 7 miljoner kronor, beroende på antagen skyddseffekt av vaccin (10/50 procent) och vaccintyp. Detta tyder på att de stora vinsterna av vaccination kommer från vaccination av gruppen 17–26 år.
Män som har sex med män
För att undersöka hur robusta resultaten från grundscenarierna är, har vi utfört ett antal känslighetsanalyser på osäkra parametrar. Eftersom en riktad insats till MSM är dominant i grundscenarierna oavsett födelsekohort som utvärderas är det inte relevant att göra en känslighetsanalys av priset på vaccin.
Tabell 30 och tabell 31 nedan redovisar resultatet från känslighetsanalyserna, där enbart nämnda parametrar ändras medan övriga parametrar gäller givet antagandena i grundscenarierna.
Följande känslighetsanalyser har gjorts:
- Hälso- och sjukvårdsperspektiv istället för samhällsperspektiv: kostnader för produktionsbortfall exkluderas ur analysen.
- Utan flockimmunitet: positiva effekter på ovaccinerade MSM exkluderas
- QALY-vikt i hälsostadierna mottaglig och återhämtad: 0,9
- Ändrad diskonteringsränta:
- Kostnader och effekter diskonteras inte
- Hälsoeffekter diskonteras med 1,5 procent
- Vaccinationstäckning justeras: vaccinationstäckningen ökas respektive minskas med 10 procentenhet i respektive åldersgrupp.
- Skyddseffekt av vaccin justeras: Skyddseffekten av vaccin justeras till 50 procent för alla individer och alla cancertyper baserat på vaccineffekt för individer med okänd status vad gäller HPV-infektion (9, 10, 35-38).
- Skyddseffekt av vaccin justeras samtidigt som multiplikationsfaktorn justeras: Skyddseffekten av vaccin justeras till 10 procent för alla individer 27 år och äldre, samt för alla cancertyper baserat på vaccineffekt för individer med okänd status vad gäller HPV-infektion. Samtidigt justerar vi ned multiplikationsfaktorn för penis- och orofarynxcancer till 7 respektive 3 (14 i grundanalysen baserat på den ökade risken för analcancer) (20).
| Känslighetsanalys | ICER Två-/fyrvalent vaccin (kronor) | ICER Niovalent vaccin (kronor) |
|---|---|---|
| Hälso- och sjukvårdsperspektiv | Dominant | Dominant |
| Utan flockimmunitet | Dominant | Dominant |
| QALY-vikt i hälsostadierna mottaglig/återhämtad: 0,9 | Dominant | Dominant |
| Diskonteringsränta0 procent för både kostnader och hälsoeffekter3 procent för kostnader, 1,5 procent för hälsoeffekter | DominantDominant | DominantDominant |
| Vaccinationstäckning– 10 procentenheter+ 10 procentenheter | DominantDominant | DominantDominant |
| Skyddseffekt av vaccin | Dominant | Dominant |
| Känslighetsanalys | ICER Två-/fyrvalent vaccin (kronor) | ICER Niovalent vaccin (kronor) | |
|---|---|---|---|
| Hälso- och sjukvårdsperspektiv | Dominant | Dominant | |
| Utan flockimmunitet | Dominant | Dominant | |
| QALY-vikt i hälsostadierna mottaglig/återhämtad: 0,9 | Dominant | Dominant | |
| Diskonteringsränta0 procent för både kostnader och hälsoeffekter3 procent för kostnader, 1,5 procent för hälsoeffekter | DominantDominant | DominantDominant | |
| Vaccinationstäckning– 10 procentenheter+ 10 procentenheter | DominantDominant | DominantDominant | |
| Skyddseffekt av vaccin 50 procent för alla åldrar | Dominant | Dominant | |
| Skyddseffekt av vaccin 10 procent för gruppen 27–45 år, multiplikationsfaktor 7 | Dominant | 45 900 | |
| Skyddseffekt av vaccin 10 procent för gruppen 27–45 år, multiplikationsfaktor 3 | 45 900 | 150 000 |
Resultaten från känslighetsanalyserna för MSM visar att resultatet är robusta för gruppen till och med 26 år där vaccination är kostnadsbesparande i samtliga analyser jämfört med ingen vaccination. För gruppen 27–45 år är resultaten känsliga för antaganden om multiplikationsfaktorn och skyddseffekt av vaccin. Vi genomförde även en analys där vi endast undersökte kostnadseffektiviteten av vaccination i gruppen 27–45 år. Kostnaden per vunnet QALY varierade då mellan ungefär 600 000 kronor för det två-/fyrvalenta vaccinet och 1,1 miljon kronor för det niovalenta vaccinet. Detta tyder på att de stora kostnadsbesparingarna av vaccination kommer från vaccination av gruppen 17–26 år.
Budgetpåverkan
Kostnaden för att genomföra en catch-up-vaccination riktad till pojkar och unga män och riktade insatser till specifika grupper (MSM, transpersoner och personer som lever med hiv) i olika födelsekohorter summeras i tabell 32 nedan. I beräkningen har vi utgått från de antaganden om vaccintäckning, populationsstorlek och listpris som vi gjort i grundscenarierna i de hälsoekonomiska utvärderingarna.
Kostnader presenteras för vaccin och administrering separat, för att möjliggöra enklare omräkningar av den totala kostnaden om vaccinet skulle upphandlas till ett lägre pris.
| Vaccinerad grupp | Vaccinkostnad två-/fyrvalent vaccin (mnkr) | Vaccinkostnad niovalent vaccin (mnkr) | Administreringskostnad (mnkr) |
|---|---|---|---|
| Pojkar och unga män 17–19 år | 233 | 397 | 28 |
| Pojkar och unga män 17–26 år | 644 | 1 095 | 77 |
| Pojkar och unga män 17–30 år | 793 | 1 349 | 95 |
| MSM 17–26 år | 51 | 87 | 6 |
| MSM 17–45 år | 118 | 200 | 14 |
| Personer som lever med hiv | 4,6 | 7,8 | 0,5 |
| Transpersoner | 20 | 34 | 2,4 |
Eftersom personer kan ingå i flera av ovanstående grupper går det inte att summera grupperna rakt av om vaccination skulle erbjudas till flera grupper, utan hänsyn måste tas till eventuellt överlapp mellan grupperna.
Det är även värt att notera att kostnaderna för vaccination kan fördelas på olika aktörer (staten, regionerna eller individerna). Hur fördelningen skulle kunna se ut om en särskild insats ska genomföras är utanför Folkhälsomyndighetens uppdrag, och specificeras därför inte närmre i detta underlag.
Samtidigt som vaccination innebär stora kostnader leder det även till besparingar inom vården till följd av färre cancerfall. Dessa besparingar görs över lång tid och beräkningar av detta finns i tabellerna i resultatavsnittet. För MSM, där den hälsoekonomiska utvärderingen visar att vaccination är dominant, är besparingarna för vården större än kostnaden för vaccination.
Diskussion
Det finns inget fast tröskelvärde för när en insats kan anses vara kostnadseffektiv i Sverige. Utifrån Socialstyrelsens riktlinjer kan en kostnad under 500 000 kronor per QALY anses vara en måttlig kostnad (1). Resultaten från den hälsoekonomiska utvärderingen av catch-up-vaccination tyder på att catch-up-vaccination av samtliga födelsekohorter och med både ett två-/fyrvalent vaccin och ett niovalent vaccin kan anses ha en rimlig kostnad i relation till dess hälsoeffekter. Gruppen 17-30 år har den lägsta kostnaden per vunnet QALY av de olika undersökta födelsekohorterna, oavsett vaccintyp. För gruppen 17–19 år behöver priset på ett niovalent vaccin minska med strax över 10 procent för att vaccination ska anses ha en måttlig kostnad enligt Socialstyrelsens riktlinjer (1). Resultaten för en riktad insats till MSM visar att vaccination är kostnadsbesparande jämfört med att ingen vaccination ges för båda de undersökta födelsekohorterna, oavsett vaccintyp.
Känslighetsanalyserna visar att resultaten från grundscenarierna i huvudsak är robusta för födelsekohorterna till och med 26 år. För dessa födelsekohorter finns också bra data på skyddseffekten av vaccin mot HPV-orsakad cancer. För personer 27 år och äldre är data inte lika tillförlitliga vad gäller skyddseffekten av vaccin. Vi genomförde därför analyser där vi undersökte kostnadseffektiviteten endast i grupperna 27–30 år för catch-up och gruppen 27–45 år för MSM. Resultaten från dessa analyser visade att den stora effekten av vaccination kom från de lägre födelsekohorterna, vilket driver resultaten i de hälsoekonomiska utvärderingarna.
Resultaten för MSM var även känsliga för antaganden om storleken på multiplikationsfaktorn för incidens av penis- och orofarynxcancer. Eftersom data saknas för den ökade incidensen av HPV-orsakad penis- och orofarynxcancer har vi i grundanalysen använt samma riskökning som för analcancer. Det är dock troligt att multiplikationsfaktorn är betydligt lägre för dessa cancertyper än den är för analcancer. När multiplikationsfaktorn justeras nedåt för penis- och orofarynxcancer minskar antalet undvikta HPV-orsakade cancerfall vid vaccination, vilket leder till en ökad kostnad per vunnet QALY.
Vi genomförde inte utvärderingar av kostnadseffektivitet för HPV-vaccination för transpersoner eller för personer som lever med hiv, eftersom vi bedömde att data för dessa grupper skulle varit särskilt osäkra på grund av heterogeniteten i grupperna. Skyddseffekten av HPV-vaccin förväntas dock vara lika hög bland transpersoner och personer som lever med hiv, som bland hivnegativa män. Eftersom personer i dessa grupper även löper en ökad risk för HPV-orsakad cancer, talar det för att vaccination av personer i dessa grupper sannolikt också skulle innebär en rimlig kostnad i förhållande till de förväntade hälsoeffekterna.
I den hälsoekonomiska utvärderingen har vi undersökt vaccination med tre doser, utifrån aktuella produktresuméer för vaccinerna. Om antalet givna doser skulle ändras från tre doser till två doser skulle kostnaden för att tillhandahålla själva vaccinen minska, men även kostnaden för att administrera vaccinet. Givet att två doser inte skulle påverka skyddseffekten av vaccination på HPV-orsakad cancer skulle detta leda till mer fördelaktiga resultat i de hälsoekonomiska utvärderingarna.
Tidigare studier på catch-up-vaccination har presenterat resultat som är i linje med de som har presenterats i denna rapport. En studie från Nederländerna av Simons et al visade att catch-up-vaccination av pojkar och unga män i åldrarna 12–26 år skulle innebära att ungefär 48 cancerfall kunde förhindras i varje kohort (720 fall totalt över en livstidshorisont) vilket skulle leda till en kostnad per vunnet QALY om ungefär 32 256 EUR (39). En studie från Australien som undersökte kostnadseffektiviteten av ett catch-up-program för MSM kom fram till en kostnad per vunnet QALY om ungefär 6 788 AUD (40).
Antalet undvikta fall presenterades i resultatdelen som det totala antalet undvikta fall, uppdelat på cancertyp, ackumulerat över en tidsperiod på 100 år. Eftersom modellen simulerar födelsekohorter som vaccineras vid ett och samma tillfälle vid simuleringens början, uppstår inget så kallat steady-state i modellen – alltså en situation där vaccination och effekt av vaccination sker samtidigt. Eftersom antalet fall per år varierar beroende på när i modellen vi befinner oss går det inte heller att tolka antalet fall som att det, delat med 100, är det genomsnittliga antalet fall per år i ett steady-state. Antalet fall av HPV-orsakad cancer som undviks sträcker sig mellan ungefär 475 fall till 2 075 fall för catch-up-vaccination av alla män beroende på födelsekohort och vaccintyp, och mellan 1 140 fall till 2 580 för MSM beroende på födelsekohort och vaccintyp under den 100-åroga tidshorisonten. Detta visar att catch-up-vaccination, både av unga män och av MSM kan ha en stor påverkan på incidensen av HPV-orsakad cancer.
En svaghet i modellen är att den inte simulerar HPV-smitta i befolkningen utan risken för HPV-orsakad cancer. Detta innebär att vi inte kan kontrollera för när i tid som en individ smittas i modellen. Detta kan påverka resultaten eftersom de flesta personer smittas i relativt tidig ålder, medan den HPV-orsakade cancern uppstår långt senare. Kostnaden per vunnet QALY minskar med fler födelsekohorter, trots att kostnaden för att vaccinera blir betydligt större när en större population vaccineras. Detta beror på att modellen undersöker antalet undvikta fall i hela den vaccinerade populationen – om populationen ökar, ökar också antalet HPV-orsakade cancerfall som kan undvikas med vaccination. När en äldre åldersgrupp vaccineras, möjliggörs också för att undvika fall närmare i tid efter vaccination, vilket innebär att de får en relativt större tyngd i utvärderingen eftersom de då inte diskonteras lika tungt. Detta är en förenkling av verkligheten, eftersom en relativt senare infektion med HPV också innebär en relativt senare HPV-orsakad cancer för den individen.
Ytterligare en svaghet i modellen är att den endast tar hänsyn till flockimmunitet i samma födelsekohort för kvinnor som för de män som simuleras – om gruppen män 17–19 år vaccineras antas det bara ha en effekt på HPV-orsakad cancer hos kvinnor som är 17–19 år vid vaccinationstillfället. Detta gäller även vid vaccination av MSM. Modellen tar inte heller hänsyn till eventuella biverkningar av varken vaccination, behandling eller sjukdom, vilket innebär att vi bortser från biverkningars eventuella påverkan på kostnader och livskvalitet i den hälsoekonomiska utvärderingen. Vi har inte heller tagit hänsyn till effekterna av vaccination på förstadier till cancer i modellen, till skillnad från de tidigare HPV-utredningarna för pojkar (3, 4). Detta kan innebära en underskattning av den verkliga effekten eftersom kostnader och livskvalitetspåverkan kan uppstå även för dessa. Vi har valt att enbart fokusera på effekten av vaccin på HPV-orsakad cancer, vilket är ett konservativt antagande.
Sammantaget har riktade insatser för catch-up-vaccination mot humant papillomvirus (HPV) till ovaccinerade pojkar och unga män till 26 års ålder samt till ovaccinerade män som har sex med män (MSM) upp till 26 års ålder en rimlig relation mellan dess kostnader och förväntade hälsoeffekter.
Referenser
- Socialstyrelsen. Metodbeskrivning för arbetet med nationella riktlinjer. 2019. Hämtad från: https://www.socialstyrelsen.se/globalassets/sharepoint-dokument/dokument-webb/nationella-riktlinjer/nationella-riktlinjer-metodbeskrivning.pdf.
- Socialdepartementet. Uppdrag att utreda behov och kostnader i fråga om vaccination mot humant papillomvirus. Diarienummer: S2023/02369. Stockholm: Socialdepartementet 2023-08-03. Hämtad från: https://www.regeringen.se/regeringsuppdrag/2023/08/uppdrag-att-utreda-behov-och-kostnader-i-fraga-om-vaccination-mot-humant-papillomvirus/.
- Folkhälsomyndigheten. Health economic evaluation of universal HPV vaccination within the Swedish national vaccination programme for children. 2017. Hämtad från: https://www.folkhalsomyndigheten.se/contentassets/a56471aac0d144c291cc3e61928790b8/health-economic-evaluation-universal-hpv-vaccination-swedish-national-vaccination-programme-children.pdf.
- Folkhälsomyndigheten. Komplettering av beslutsunderlag om HPV-vaccination av pojkar (dnr 1101/2019). Solna; 2019.
- International Human Papillomavirus Reference Center (IRHC). Utrotning av HPV och livmoderhalscancer, https://www.hpvcenter.se/utrotning/. 2023. Hämtad från: https://www.hpvcenter.se/utrotning/.
- Wolff E, Elfström KM, Haugen Cange H, Larsson S, Englund H, Sparén P, et al. Cost-effectiveness of sex-neutral HPV-vaccination in Sweden, accounting for herd-immunity and sexual behaviour. Vaccine. 2018;36(34):5160-5. DOI:10.1016/j.vaccine.2018.07.018.
- Folkhälsomyndigheten. Nationella folkhälsoenkäten "Hälsa på lika villkor?". 2022. Hämtad från: https://www.folkhalsomyndigheten.se/folkhalsorapportering-statistik/om-vara-datainsamlingar/nationella-folkhalsoenkaten/.
- Amantea C, Foschi N, Gavi F, Borrelli I, Rossi MF, Spuntarelli V, et al. HPV Vaccination Adherence in Working-Age Men: A Systematic Review and Meta-Analysis. Vaccines (Basel). 2023;11(2). DOI:10.3390/vaccines11020443.
- Giuliano AR, Palefsky JM, Goldstone S, Moreira ED, Jr., Penny ME, Aranda C, et al. Efficacy of quadrivalent HPV vaccine against HPV Infection and disease in males. N Engl J Med. 2011;364(5):401-11. DOI:10.1056/NEJMoa0909537.
- Goldstone SE, Jessen H, Palefsky JM, Giuliano AR, Moreira ED, Jr., Vardas E, et al. Quadrivalent HPV vaccine efficacy against disease related to vaccine and non-vaccine HPV types in males. Vaccine. 2013;31(37):3849-55. DOI:10.1016/j.vaccine.2013.06.057.
- Bruni L, Albero G, Rowley J, Alemany L, Arbyn M, Giuliano AR, et al. Global and regional estimates of genital human papillomavirus prevalence among men: a systematic review and meta-analysis. Lancet Glob Health. 2023;11(9):e1345-e62. DOI:10.1016/s2214-109x(23)00305-4.
- Wei F, Gaisa MM, D'Souza G, Xia N, Giuliano AR, Hawes SE, et al. Epidemiology of anal human papillomavirus infection and high-grade squamous intraepithelial lesions in 29 900 men according to HIV status, sexuality, and age: a collaborative pooled analysis of 64 studies. The Lancet HIV. 2021;8(9):e531-e43. DOI:https://doi.org/10.1016/S2352-3018(21)00108-9.
- HPV Information Centre. Statistics, Data Query, HPV prevalence estimates - HPV type distribution.
- Näsman A, Nordfors C, Holzhauser S, Vlastos A, Tertipis N, Hammar U, et al. Incidence of human papillomavirus positive tonsillar and base of tongue carcinoma: a stabilisation of an epidemic of viral induced carcinoma? Eur J Cancer. 2015;51(1):55-61. DOI:10.1016/j.ejca.2014.10.016.
- Kirrander P, Kolaric A, Helenius G, Windahl T, Andrén O, Stark JR, et al. Human papillomavirus prevalence, distribution and correlation to histopathological parameters in a large Swedish cohort of men with penile carcinoma. BJU International. 2011;108(3):355-9. DOI:https://doi.org/10.1111/j.1464-410X.2010.09770.x.
- Socialstyrelsen. Statistikdatabas för cancer. 2018-2022.
- Plummer M, de Martel C, Vignat J, Ferlay J, Bray F, Franceschi S. Global burden of cancers attributable to infections in 2012: a synthetic analysis. Lancet Glob Health. 2016;4(9):e609-16. DOI:10.1016/s2214-109x(16)30143-7.
- Deshmukh AA, Damgacioglu H, Georges D, Sonawane K, Clifford GM. Human Papillomavirus-Associated Anal Cancer Incidence and Burden Among US Men, According to Sexual Orientation, Human Immunodeficiency Virus Status, and Age. Clin Infect Dis. 2023;77(3):419-24. DOI:10.1093/cid/ciad205.
- Centers for Disease Control and Prevention. Sexually Transmitted Diseases. 2022. Hämtad från: https://www.cdc.gov/msmhealth/STD.htm
- Heck JE, Berthiller J, Vaccarella S, Winn DM, Smith EM, Shan'gina O, et al. Sexual behaviours and the risk of head and neck cancers: a pooled analysis in the International Head and Neck Cancer Epidemiology (INHANCE) consortium. Int J Epidemiol. 2010;39(1):166-81. DOI:10.1093/ije/dyp350.
- Regionala Cancercentrum i samverkan. Datautdrag från Kvalitetsregister för gynekologisk cancer. 2018-2022.
- Chesson HW, Ekwueme DU, Saraiya M, Dunne EF, Markowitz LE. The cost-effectiveness of male HPV vaccination in the United States. Vaccine. 2011;29(46):8443-50. DOI:https://doi.org/10.1016/j.vaccine.2011.07.096.
- Skatteverket. Arbetsgivaravgifter. 2024 [citerad 2024-02-20]. Hämtad från: https://www.skatteverket.se/foretag/arbetsgivare/arbetsgivaravgifterochskatteavdrag/arbetsgivaravgifter.
- Statistiska centralbyrån (SCB). Lönestatistik. [uppdaterad 2024-02-20]. Hämtad från: https://www.scb.se/hitta-statistik/sverige-i-siffror/lonesok/.
- Apoteket. Gardasil 9 (10 x 1 x 0,5 ml). [citerad 2024-03-14]. Hämtad från: https://www.apoteket.se/.
- Sveriges kommuner och regioner (SKR). KPP Databas. Somatiska diagnoser. Basrapport sluten- och öppenvård. 2020-2022 [citerad 2024-02-08]. Hämtad från: https://skr.se/skr/halsasjukvard/ekonomiavgifter/kostnadperpatientkpp/kppdatabas.46722.html.
- Region Skåne. Prislistor bild- och funktionsmedicin. 2024. Hämtad från: https://vardgivare.skane.se/patientadministration/avgifter-och-prislistor/prislistor-bild-funktionsmedicin/.
- Apoteket. Mitomycin Substipharm (1 x 20 mg). [citerad 2024-02-19]. Hämtad från: https://www.apoteket.se/produkt/mitomycin-substipharm-pulver-och-vatska-till-intravesikal-losning-20-mg-1-x-20-milligram-kombinationsforpackning-759981/
- Region Stockholm. Prislista Avtalsläkemedel Region Stockholm och Region Gotland mars 2024. [citerad 2024-03-14]. Hämtad från: https://contracts.tendsign.com/ContractArea/Details/1579312?eId=2XwXmS0zykSquwLRsSricwA%3d.
- Region Östergötland. Upphandlade läkemedel. Avtalade läkemedel från 1 mars 2023 (senast uppdaterad 2024-01-24). [citerad 2024-02-20]. Hämtad från: https://vardgivare.regionostergotland.se/vgw/kunskapsstod/lakemedel/lakemedel-och-ekonomi/upphandlade-lakemedel.
- Försäkringskassan. Datautdrag från Försäkringskassans statistikdatabas. 2021-2022.
- Statistiska centralbyrån (SCB). Lönestrukturstatistik, hela ekonomin. Genomsnittlig månadslön efter sekton 1992-2022. Samtliga sektorer (totalt män och kvinnor). 2022 [citerad 2024-02-15]. Hämtad från: https://www.scb.se/hitta-statistik/statistik-efter-amne/arbetsmarknad/loner-och-arbetskostnader/lonestrukturstatistik-hela-ekonomin/pong/tabell-och-diagram/genomsnittlig-manadslon-efter-sektor/.
- Myers E, Green S, Lipkus I, redaktörer. Patient preferences for health states related to HPV infection: visual analogue scales vs. time trade-off elicitation. Proceedings of the 21st International Papillomavirus Conference; 2004.
- Conway EL, Farmer KC, Lynch WJ, Rees GL, Wain G, Adams J. Quality of life valuations of HPV-associated cancer health states by the general population. Sex Transm Infect. 2012;88(7):517-21. DOI:10.1136/sextrans-2011-050161.
- FASS. Gardasil 9 Produktresumé (SPC) [uppdaterad maj 2023]. Hämtad från: https://www.fass.se/LIF/product?userType=2&nplId=20140314000038&docType=6&scrollPosition=736.
- Rosado C, Fernandes AR, Rodrigues AG, Lisboa C. Impact of Human Papillomavirus Vaccination on Male Disease: A Systematic Review. Vaccines (Basel). 2023;11(6). DOI:10.3390/vaccines11061083.
- FASS. Gardasil Produktresumé (SPC) [uppdaterad november 2022]. Hämtad från: https://www.fass.se/LIF/product?userType=0&nplId=20051216000111&docType=6&scrollPosition=479.3333435058594.
- European Centre for Disease Prevention and Control (ECDC). Guidance on HPV vaccination in EU countries: focus on boys, people living with HIV and 9-valent HPV vaccine introduction 2020. Hämtad från: https://www.ecdc.europa.eu/sites/default/files/documents/Guidance-on-HPV-vaccination-in-EU-countries2020-03-30.pdf.
- Simons JJM, Westra TA, Postma MJ. Cost-effectiveness of a male catch-up human papillomavirus vaccination program in the Netherlands. Prev Med Rep. 2022;28:101872. DOI:10.1016/j.pmedr.2022.101872.
- Zhang L, Regan DG, Ong JJ, Gambhir M, Chow EPF, Zou H, et al. Targeted human papillomavirus vaccination for young men who have sex with men in Australia yields significant population benefits and is cost-effective. Vaccine. 2017;35(37):4923-9. DOI:10.1016/j.vaccine.2017.07.078.
